pH计作为实验室和工业生产中常用的分析仪器,其测量结果的准确性直接关系到化学反应的监控、水质评估以及生物培养等关键环节。然而,在实际应用中,温度是影响pH检测结果的核心变量之一。温度变化不仅会改变溶液本身的化学性质,还会干扰电极的响应特性,甚至影响仪器的校准与补偿功能。本文将从理论机制、实际影响及应对策略三个方面,分析温度对pH计检测的影响。
一、温度对溶液pH值的影响机制
溶液的pH值本质上是溶液中氢离子(H⁺)活度的负对数,而温度变化会通过以下两种途径改变溶液的pH值:
1.中性溶液的pH值随温度偏移
纯水的解离反应(H₂O ⇌ H⁺ + OH⁻)是一个吸热过程。温度升高时,水的解离度增大,H⁺和OH⁻的浓度同时增加,但二者的浓度仍相等。因此,纯水的中性点pH值会随温度变化:
0℃时,中性pH为7.47;
25℃时,中性pH为7.00;
100℃时,中性pH为6.14。
这一现象表明,若以“pH=7”作为中性标准,在非25℃条件下可能导致误判。
2.温度对弱酸/弱碱溶液的影响
弱酸或弱碱的解离平衡受温度显著影响。例如,氨水(NH₃·H₂O)的解离度随温度升高而降低,导致其pH值下降;而醋酸(CH₃COOH)的解离度随温度升高而增加,pH值相应降低。对于缓冲溶液(如磷酸盐缓冲液),其pH值也会随温度波动,需根据实际温度修正标称值。
二、温度对pH电极性能的影响
pH电极的核心是玻璃膜与参比电极组成的电化学系统,其响应特性与温度密切相关:
1.能斯特方程与温度的关系
pH电极的电位响应遵循能斯特方程:
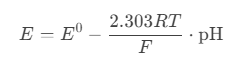
其中,斜率项( )与温度(T)成正比。温度每升高1℃,理论斜率增加约0.198 mV/pH。例如:
)与温度(T)成正比。温度每升高1℃,理论斜率增加约0.198 mV/pH。例如:
在25℃时,理想斜率为59.16 mV/pH;
在10℃时,斜率降至56.18 mV/pH。
若仪器未根据温度调整斜率,会导致测量值偏离真实pH。
2.电极响应速度与稳定性
低温环境下(如<5℃),玻璃膜的离子交换速率下降,电极响应时间延长,读数可能出现漂移;高温环境下(如>50℃),参比电极内部的KCl电解液扩散速率加快,可能引发液接电位异常,同时加速玻璃膜老化。
三、温度补偿功能的局限性
现代pH计普遍配备自动温度补偿(ATC)功能,但其有效性受以下限制:
1.补偿范围的限制
大多数商用pH计的ATC范围为0~100℃,但在接近极限温度时,补偿精度可能下降。例如,测量120℃的高温溶液时,温度传感器可能失效,导致补偿失效。
2.温度探头的校准误差
若温度探头未与溶液充分接触(如仅测量环境温度而非溶液实际温度),或探头本身存在偏差,补偿后的pH值仍会产生系统误差。
3.温度突变对电极的损害
将低温保存的电极直接插入高温溶液中,可能因玻璃膜热胀冷缩不均而破裂;反之,高温电极骤冷也可能导致内部电解液结晶。
四、校准过程中的温度干扰
pH计的校准依赖于标准缓冲液,而缓冲液的pH值同样具有温度依赖性:
1.缓冲液标称值的温度修正
以常用pH 6.86磷酸盐缓冲液为例:
在15℃时,其实际pH值为6.90;
在25℃时,pH值为6.86;
在35℃时,pH值为6.84。
若校准过程中未根据实际温度调整,仪器会误将偏离值作为基准,导致后续测量整体偏移。
2.温度差异引入的校准误差
若校准液与待测样品温度差异较大(如校准液为25℃,样品为5℃),即使启用ATC功能,电极的斜率与零点仍可能无法准确匹配。
五、应对温度影响的优化策略
1.控制测量环境温度
尽量使样品、电极和校准液处于相同温度(±2℃内);
对高温或低温样品,可预先水浴控温至接近室温后再测量。
2.规范校准与补偿操作
校准前需输入缓冲液的实际温度值;
选择支持多温度点校准的高精度pH计(如支持5℃、25℃、50℃三点校准);
定期校验温度探头的准确性。
3.电极使用与维护
避免电极经历剧烈温度变化,测量高温样品前需用温水逐步预热;
选择耐高温电极(如钛合金外壳、特殊玻璃膜型号)用于极端条件;
长期不使用时,电极应保存在3 mol/L KCl溶液中并置于室温环境。
六、总结
温度对pH计检测的影响贯穿于溶液性质、电极响应、仪器补偿及校准全流程。在实际操作中,需充分理解温度与pH值的动态关系,通过标准化操作和仪器优化,最大限度降低温度干扰。尤其在高精度实验或工业在线监测中,建议结合实时温度记录与数据修正算法,进一步提升检测结果的可靠性。唯有综合考虑温度的多维度影响,才能确保pH计在复杂环境下的科学性与实用性。
注:本文属海博生物原创,未经允许不得转载。



















搜产品